Preciso validar meu software. Por onde começo?
A decisão de executar uma validação de software pode vir de uma exigência normativa ou pela demanda de proteção e garantia dos dados. Tudo depende do valor que a informação pode representar para o negócio.
Porém, a validação de software pode ser um assunto confuso até mesmo entre as empresas que são obrigadas a executá-la. Mas fique tranquilo, neste post iremos desmistificar de vez este assunto.
Vamos lá?
O que é validação de software?
A validação de software é um processo que comprova documentalmente que o sistema cumpre com as funções das quais foi designado, em conformidade com as especificações dos requisitos do usuário e com a garantia de segurança e rastreabilidade de informações.
Minha empresa precisa fazer validação de software?
Qualquer empresa pode optar por executar o procedimento de validação do software como ação de boas práticas para evitar danos ao consumidor e a imagem da empresa.
Mas para alguns segmentos, como é o caso das industrias farmacêuticas, é uma exigência que determinados sistemas computadorizados sejam validados de modo a garantir o cumprimento de sua função.
Qualquer sistema computadorizado precisa ser validado?
Infelizmente não existe uma lista mestra contendo todos os nomes de todos os sistemas que os órgãos regulamentadores exigem que sejam validados. Porém existem guias de perguntas, como o Guia da ANVISA, que ajudam a classificar se o sistema precisa ou não ser validado.
Basicamente, todos os sistemas computadorizados que tenham relação direta ou indireta com a produção de medicamento/produto para saúde ou impacto na rastreabilidade dos mesmos devem ser validados.
Por onde começar a validação de software?
Como ponto de partida, muitas empresas utilizam o guia GAMP5 (Good Automated Manufacturing Practice) – Boas Práticas de Manufatura Automatizada. O guia está atualmente na versão 5, e apresenta como eixo central a estratégia de validar baseado em risco (A Risk Based Approach to Compliant GxP Computerized Systems).
O Guia da ANVISA, que tem o GAMP5 como principal referência, utiliza muito o termo BPx.
BPx – Boas Práticas – é a tradução do termo GxP, usado no Guia de validação de sistemas da ANVISA.
GxP – Good Practices – termo geral para aplicação de boas práticas relacionadas a qualquer área (fabricação, distribuição, pesquisa clínica, laboratório, etc.).
Basicamente, se o sistema tem impacto BPx, então existe a necessidade de validação do sistema. O segundo passo é verificar se o sistema é ou não validável. Depois disso, segue-se para o plano de validação, como mostra o fluxograma abaixo.
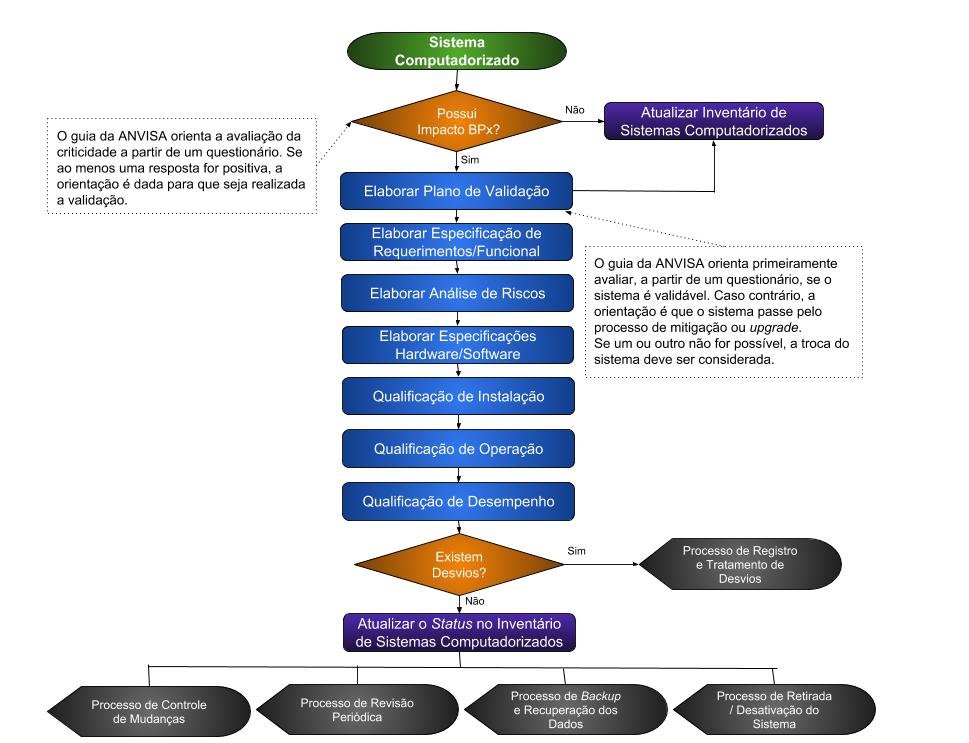
Fluxograma 1: Validação de Software
Não existe um modelo padrão para o Plano de Validação. Na verdade, cada empresa pode elaborar o seu Plano Mestre de Validação com base em suas políticas e metodologias.
Independente do plano, algumas documentações fazem parte do escopo:
- URS (User Requirement Specification)
- FRS (Functional Requirement Specification)
- IQ (Installation Qualification)
- OQ (Operational Qualification)
- PQ (Performance Qualification)
- etc. (traremos mais detalhes quanto ao escopo destes documentos em um próximo post)
Uma vez realizada a validação, é necessário um gerenciamento de manutenção e verificação da validade dos procedimentos. Tais procedimentos são representados pelos componentes destacados em preto no Fluxograma 1 e fazem parte das atividades de suporte do sistema.
Para compreender melhor a a necessidade e a importância de tais procedimentos durante e após a validação, é preciso compreender a definição do Ciclo de Vida de um sistema. Ele é composto de quatro fases principais: Conceito, Projeto, Operação e Descontinuidade.
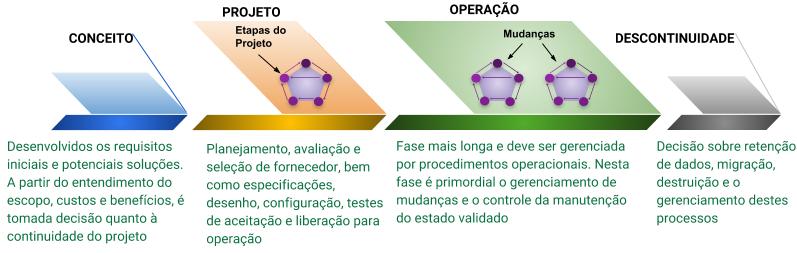
Fluxograma 2: Ciclo de Vida do Sistema
Mas atenção, o Ciclo de Vida aqui descrito não deve ser confundido com a necessidade de se definir abordagem ou método para desenvolvimento de software pelo fornecedor.
As etapas dentro da fase de Projeto são as etapas que também podem acontecer durante a fase de Operação, quando houver a necessidade de mudanças.
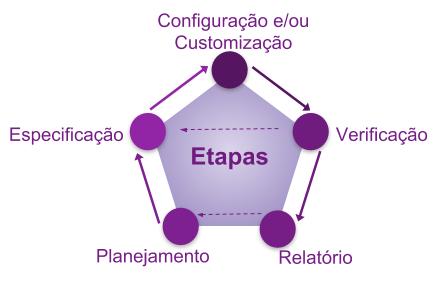
Fluxograma 3: Etapas do Projeto
As etapas do projeto são:
Planejamento
É importante que os requisitos do usuário estejam claros e documentados. A abordagem desta fase deve estar baseada no entendimento do processo, produto e requisitos regulatórios pertinentes.
Em muitos casos é necessário cumprir com os requisitos da FDA CFR 21 Part 11, que se prevista desde o início do projeto, traz a segurança e rastreabilidade necessária para o bom uso do sistema.
Especificação e Configuração
A etapa de especificação visa permitir que o sistema seja desenvolvido na etapa de configuração, verificado e mantido.
Verificação
São realizados testes de desafio com o objetivo de verificar se as especificações foram atendidas, podendo envolver vários ciclos de revisão e testes dependendo do tipo de sistema, método de desenvolvimento utilizado e seu uso.
Relatório
Recomenda-se que o relatório contemple o resumo das atividades realizadas, desvios encontrados, eventos inesperados, ações corretivas e a comprovação da conformidade aos requisitos especificados e ao uso pretendido para o sistema.
A aceitação e liberação de um sistema com impacto em BPx requer a aprovação do responsável pelo processo, responsável pelo sistema e representante da unidade da qualidade.
Resumo
- A validação na verdade é apenas uma parte do Ciclo de Vida do sistema, do qual desenvolve-se uma série de atividades de suporte para gerenciamento de todas as fases do Ciclo.
- A validação de software é um processo de construir evidências documentadas de que o sistema faz o que ele deve fazer. Isto expressa bem o benefício que a validação pode trazer e a justificativa para o esforço de executá-la.
- Buscamos neste post mostrar para você os primeiros passos para compreender o processo de validação de software e por onde começar a partir de uma visão macro de todas as etapas, demonstrando a exigência de um forte envolvimento também das áreas de qualidade e produção.
Propositalmente, deixamos de lado um assunto essencial dentre as atividades de suporte ao processo de validação de software, que é o Gerenciamento de Riscos. É fundamental buscar aplicá-lo em todas as fases do Ciclo de Vida para remover ou reduzir os riscos a um nível aceitável.
Você pode continuar a leitura sobre esse assunto no artigo Como realizar o gerenciamento de riscos na validação de software?
Se você ficou com alguma dúvida sobre o processo de validação de software, escreva para a gente nos comentários. Se a sua empresa precisa de ajuda com a validação de software ou cumprimento com a FDA CFR 21 Part 11, entre em contato conosco para mais detalhes de como a nossa equipe pode auxiliá-lo neste processo.

Engenheira de Alimentos pela UFSC com certificação Green Belt. Trabalha na HarboR desde 2009 atuando na capacitação, implementação e suporte técnico na área de Controle Estatístico de Processo e Qualidade em diferentes áreas da indústria.







Preciso fazer uma validação de um software de gestão de dados e processo e o dono do software disse que era necessário fazer um registro no sindicado da categoria, eu trabalho a muito tempo com validação via ANVISA e nunca ouvi falar deste teste, vcs sabem de algo assim?
Oi, Carla! Tudo bem?
Obrigada pelo contato, mas infelizmente não conseguimos te ajudar. Nunca ouvimos falar sobre esse registro no sindicato.
[…] Para comprovar o cumprimento, as empresas elaboram documentações e scripts de validação de sistemas eletrônicos que verificam a aderência ao regulamento da FDA. Saiba mais no post Preciso validar meu software. Por onde começo? […]
Boa noite! Trabalho com vendas, instalação e calibração de instrumentos de medição para processos industriais.
Tenho um cliente que fabrica fios cirúrgicos, ele precisa monitorar e registrar temperatura e umidade ambiente em 10 salas de sua área de produção.
Pretendo instalar Dataloggrs, porém o software precisa ser validado. Como proceder para obter validação para esta aplicação. Grato!
Olá, Eliezer, obrigado pelo contato. A validação em si é sempre um processo individualizado para cada cliente usuário do seu sistema, ainda que possa ser bastante similar entre eles. De maneira muito resumida, é preciso definir as funções que o sistema deve cumprir, elaborar um roteiro de testes/desafios que verificam que o sistema cumpre essas funções, e executar e documentar os resultados da execução desse roteiro. Parece bastante abstrato, mas as referências citadas no post guiam esse trabalho. Nós da HarboR podemos ajudar a elaborar, executar e documentar resultados para seu cliente. Entre em contato com a gente para saber mais.
Boa noite Andreia. Somos uma empresa de Calibração e precisa validar de uma Documentação de validação dos instrumentos que utilizo( data logger)conforme CRF 21, part 11. Fazemos Qualificação Térmica e utilizamos de loggers testo 174h. Gostaria de saber se fazer, qual valor?
Danilo,
obrigado, vamos entrar em contato com você para entender sua necessidade.
Tenho um cliente que produz software para denominações e eleições empresarial, societário e outras, quer validar seu software de eleição, mas eu sou consultor de Gestão da qualidade, quero passar esse serviço de validação para quem faz com competência, por isso estou contatando vocês, aguardo retorno.
boa tarde sou analista de uma software house e estou desenvolvendo um software de controle de cadeira de custodia de amostras e meu cliente pediu que seja validado. Como faco, e necessário a contratação de uma empresa para validar ?
Bom dia Claudio, muito obrigada pelo contato. O processo de validação do software, com relação à conformidade aos requisitos da ANVISA, se baseia em executar e documentar todas as evidências de que o sistema atende aos requisitos, assim como implementar uma rotina de manutenção do estado validado do sistema. Portanto, o sistema a ser validado deve ser desenvolvido de modo a permitir o atendimento às boas práticas de segurança e rastreabilidade de dados, assim como aos requisitos exigidos pelo cliente. A HarboR presta o serviço tanto na etapa de desenvolver os protocolos de teste e executar a validação do sistema assim como orientar ao desenvolvedor do sistema o que é necessário contemplar para permitir o atendimento aos requisitos regulatórios. Se preferir, podemos marcar um horário para conversar e discutir mais detalhes. Ficamos no aguardo do seu contato. Muito obrigada.
Olá Andrea! Boa tarde. Sou analista de qualidade em uma empresa do ramo automotivo que utilização o software vector VN1630A. Este, simula a utilização de comandos de central multimídia através do volante do veículo. Numa pré auditoria ISO fomos questionados sobre a validação deste software. Poderia dizer se nesse caso é necessário a validação?
Boa tarde, obrigada pelo contato. A validação de software é um controle que pode ser implementado em qualquer segmento. Porém, para alguns segmentos este processo é algo obrigatório para a obtenção do certificado de boas práticas, que é o caso da indústria farmacêutica por exemplo. Nestes casos, o processo de validação consiste em várias etapas (descritas nessa série de posts sobre validação). Quanto ao segmento automotivo, eu desconheço a obrigatoriedade de implementar validação de software nos mesmos moldes requeridos para a indústria farmacêutica, porém é algo que eu precisaria me aprofundar um pouco mais antes de lhe confirmar com mais precisão. Acredito que no seu caso, o auditor possa estar se referindo a testes para comprovar a correta performance do seu sistema, ou seja o que foi feito ou considerado que comprove que o sistema simula de forma consistente estes comandos multimídia. Não necessariamente estes testes precisam estar dispostos nos moldes que abordamos para as indústrias reguladas pela ANVISA. Obrigada