Necesito validar mi software. ¿Por dónde empiezo?
La decisión de ejecutar una validación de software puede venir de un requisito normativo o por la demanda de protección y garantía de los datos. Todo depende del valor que la información puede representar para el negocio.
Sin embargo, la validación de software puede ser un asunto confuso incluso entre las empresas que están obligadas a ejecutarla. Pero quédese tranquilo, en este post nosotros vamos a desmitificar de una vez para siempre este asunto.
¿Vamos allá?
¿Qué es la validación de software?
La validación de software es un proceso que demuestra a partir de documentos que el sistema cumple con las funciones de las cuales fue designado, de acuerdo con las especificaciones de los requisitos del usuario y con la garantía de seguridad y trazabilidad de informaciones.
¿Mi empresa necesita hacer la validación de software?
Cualquier empresa puede optar por ejecutar el procedimiento de validación de software como acción de buenas prácticas para evitar daños al consumidor y la imagen de la empresa.
Pero para algunos seguimientos, como es el caso de las industrias farmacéuticas, es una exigencia que determinados sistemas computarizados sean validados para garantizar el cumplimiento de su función.
¿Cualquier sistema computarizado necesita ser validado?
Desafortunadamente, no existe una lista maestra con todos los nombres de todos los sistemas que los organismos reguladores exigen que se validen. Pero existen guías de preguntas, como la Guía de la ANVISA (Agencia Nacional Brasileña de Vigilancia Sanitaria), que ayudan a clasificar si el sistema necesita o no ser validado.
Básicamente, todos los sistemas computarizados que tengan relación directa o indirecta con la producción de medicinas/producto para la salud o impacto en la trazabilidad de los mismos deben ser validados.
¿Por dónde empezar la validación de software?
Como punto de partida, muchas empresas utilizan la guía GAMP5 (Good Automated Manufacturing Practice) – Buenas Prácticas de Manufactura Automatizada. La guía está actualmente en la versión 5, y presenta como eje central la estrategia de validación basada en riesgos (A Risk Based Approach to Compliant GxP Computerized Systems).
La Guía de la ANVISA, que tiene el GAMP5 como principal referencia utiliza mucho el término BPx.
BPx – Buenas Prácticas – es la traducción del término GxP, usado en la Guía de validación de sistemas de la ANVISA.
GxP – Good Practices – término general para aplicación de las buenas prácticas relacionadas con cualquier área (fabricación, distribución, investigación clínica, laboratorio, etc.).
Básicamente, si el sistema tiene impacto BPx, entonces existe la necesidad de validación del sistema. El segundo paso es comprobar si el sistema es o no validable. Después de eso, se sigue al plan de validación, como muestra el diagrama de flujo a continuación.
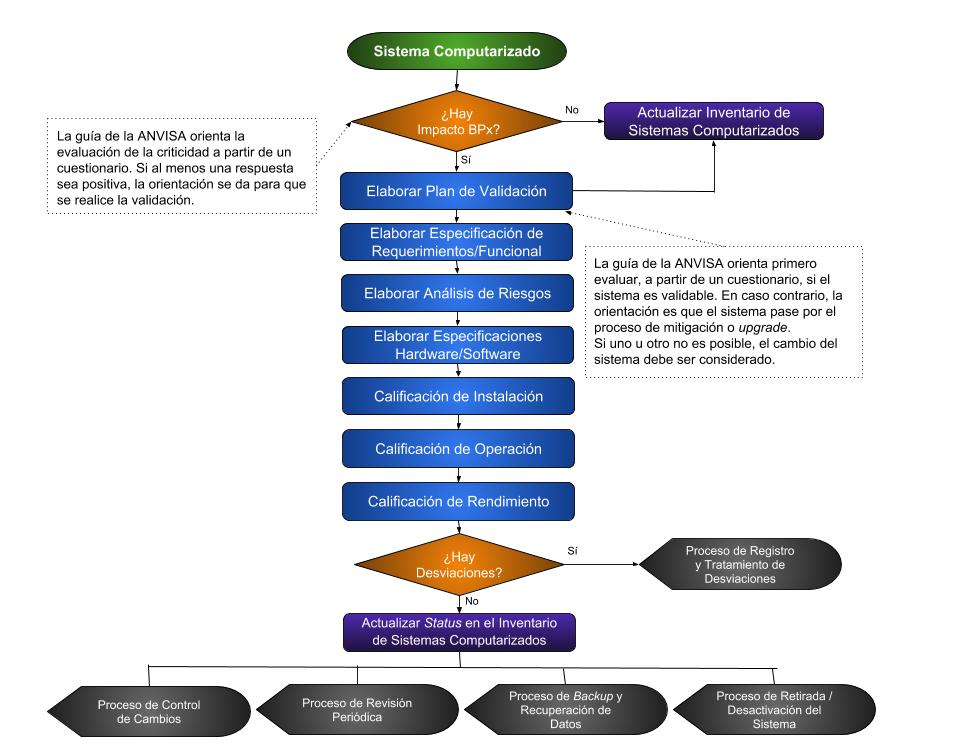
Diagrama de Flujo 1: Validación de Software
No existe un modelo estándar para el Plan de Validación. En realidad, cada empresa puede elaborar su Plan Maestro de Validación basado en sus políticas y metodologías.
Independiente del plan, algunas documentaciones forman parte del alcance:
- URS (User Requirement Specification)
- FRS (Functional Requirement Specification)
- IQ (Installation Qualification)
- OQ (Operational Qualification)
- PQ (Performance Qualification)
- etc. (vamos a ver más detalles sobre el alcance de estos documentos en un próximo post)
Una vez realizada la validación, es necesaria una gestión de mantenimiento y verificación de la validez de los procedimientos. Estos procedimientos son representados por los componentes destacados en negro en el diagrama de flujo 1 y forman parte de las actividades de soporte del sistema.
Para comprender mejor la necesidad y la importancia de estos procedimientos durante y después de la validación, es necesario comprender la definición del Ciclo de Vida de un sistema. Se compone de cuatro fases principales: Concepto, Proyecto, Operación y Discontinuidad.
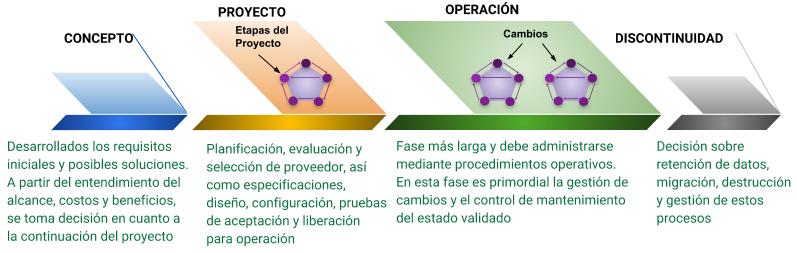
Diagrama de Flujo 2: Ciclo del Vida del Sistema
Pero atención, el Ciclo de Vida aquí descrito no debe confundirse con la necesidad de definir el enfoque o método para el desarrollo de software por el proveedor.
Las etapas dentro de la fase de Proyecto son las etapas que también pueden ocurrir durante la fase de Operación, cuando haya la necesidad de cambios.
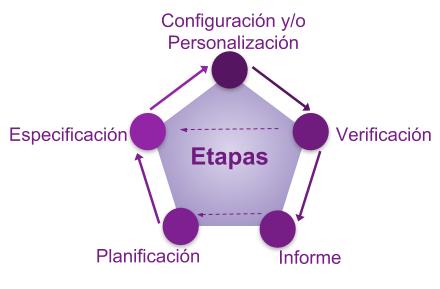
Diagrama de Flujo 3: Etapas del Proyecto
Las etapas del proyecto son:
Planificación
Es importante que los requisitos del usuario estén claros y documentados. El enfoque de esta fase debe estar basado en el entendimiento del proceso, producto y requisitos regulatorios pertinentes.
En muchos casos es necesario cumplir con los requisitos de la FDA CFR 21 Part 11, que si se prevé desde el inicio del proyecto, trae la seguridad y trazabilidad necesaria para el buen uso del sistema.
Especificación y Configuración
La etapa de especificación tiene como objetivo permitir que el sistema sea desarrollado en el paso de configuración, verificado y mantenido.
Verificación
Se realizan pruebas de reto con el objetivo de verificar si las especificaciones fueron atendidas, pudiendo involucrar varios ciclos de revisión y pruebas dependiendo del tipo de sistema, método de desarrollo utilizado y su uso.
Informe
Se recomienda que el informe contemple el resumen de las actividades realizadas, desvíos encontrados, eventos inesperados, acciones correctivas y la comprobación de la conformidad a los requisitos especificados y al uso previsto para el sistema.
La aceptación y liberación de un sistema con impacto en BPx requiere la aprobación del responsable del proceso, responsable del sistema y representante de la unidad de calidad.
Resumen
- La validación en realidad es sólo una parte del Ciclo de Vida del sistema, del cual se desarrolla una serie de actividades de soporte para la gestión de todas las fases del Ciclo.
- La validación es un proceso de construir evidencias documentadas de que el sistema hace lo que debe hacer. Esto expresa bien el beneficio que la validación puede traer y la justificación para el esfuerzo de ejecutarla.
- Buscamos en este post mostrar para usted los primeros pasos para comprender el proceso de validación de software y por dónde empezar a partir de una visión macro de todas las etapas, demostrando la exigencia de una fuerte implicación también de las áreas de calidad y producción.
De modo intencional, dejamos de lado un asunto esencial entre las actividades de soporte al proceso de validación de software, que es la Gestión de Riesgos. Es fundamental buscar aplicarlo en todas las fases del Ciclo de Vida para remover o reducir los riesgos a un nivel aceptable.
Usted puede continuar leyendo sobre este tema en el artículo ¿Cómo realizar la gestión de riesgos en la validación de software?
Si usted tiene alguna duda sobre el proceso de validación de software, escriba para nosotros en los comentarios. Si su empresa necesita ayuda con la validación de software o cumplimiento con la FDA CFR 21 Part 11, póngase en contacto con nosotros para más detalles sobre cómo nuestro equipo puede ayudarle en este proceso.

Ingeniera de Alimentos formanda en la Universidad Federal de Santa Catarina con certificación Green Belt. Trabaja en HarboR desde 2009 actuando en la capacitación, implementación y soporte técnico en el área de Control Estadístico de Proceso y Calidad en diferentes áreas de la industria.







Preciso fazer uma validação de um software de gestão de dados e processo e o dono do software disse que era necessário fazer um registro no sindicado da categoria, eu trabalho a muito tempo com validação via ANVISA e nunca ouvi falar deste teste, vcs sabem de algo assim?
Oi, Carla! Tudo bem?
Obrigada pelo contato, mas infelizmente não conseguimos te ajudar. Nunca ouvimos falar sobre esse registro no sindicato.
[…] Para comprovar o cumprimento, as empresas elaboram documentações e scripts de validação de sistemas eletrônicos que verificam a aderência ao regulamento da FDA. Saiba mais no post Preciso validar meu software. Por onde começo? […]
Boa noite! Trabalho com vendas, instalação e calibração de instrumentos de medição para processos industriais.
Tenho um cliente que fabrica fios cirúrgicos, ele precisa monitorar e registrar temperatura e umidade ambiente em 10 salas de sua área de produção.
Pretendo instalar Dataloggrs, porém o software precisa ser validado. Como proceder para obter validação para esta aplicação. Grato!
Olá, Eliezer, obrigado pelo contato. A validação em si é sempre um processo individualizado para cada cliente usuário do seu sistema, ainda que possa ser bastante similar entre eles. De maneira muito resumida, é preciso definir as funções que o sistema deve cumprir, elaborar um roteiro de testes/desafios que verificam que o sistema cumpre essas funções, e executar e documentar os resultados da execução desse roteiro. Parece bastante abstrato, mas as referências citadas no post guiam esse trabalho. Nós da HarboR podemos ajudar a elaborar, executar e documentar resultados para seu cliente. Entre em contato com a gente para saber mais.
Boa noite Andreia. Somos uma empresa de Calibração e precisa validar de uma Documentação de validação dos instrumentos que utilizo( data logger)conforme CRF 21, part 11. Fazemos Qualificação Térmica e utilizamos de loggers testo 174h. Gostaria de saber se fazer, qual valor?
Danilo,
obrigado, vamos entrar em contato com você para entender sua necessidade.
Tenho um cliente que produz software para denominações e eleições empresarial, societário e outras, quer validar seu software de eleição, mas eu sou consultor de Gestão da qualidade, quero passar esse serviço de validação para quem faz com competência, por isso estou contatando vocês, aguardo retorno.
boa tarde sou analista de uma software house e estou desenvolvendo um software de controle de cadeira de custodia de amostras e meu cliente pediu que seja validado. Como faco, e necessário a contratação de uma empresa para validar ?
Bom dia Claudio, muito obrigada pelo contato. O processo de validação do software, com relação à conformidade aos requisitos da ANVISA, se baseia em executar e documentar todas as evidências de que o sistema atende aos requisitos, assim como implementar uma rotina de manutenção do estado validado do sistema. Portanto, o sistema a ser validado deve ser desenvolvido de modo a permitir o atendimento às boas práticas de segurança e rastreabilidade de dados, assim como aos requisitos exigidos pelo cliente. A HarboR presta o serviço tanto na etapa de desenvolver os protocolos de teste e executar a validação do sistema assim como orientar ao desenvolvedor do sistema o que é necessário contemplar para permitir o atendimento aos requisitos regulatórios. Se preferir, podemos marcar um horário para conversar e discutir mais detalhes. Ficamos no aguardo do seu contato. Muito obrigada.
Olá Andrea! Boa tarde. Sou analista de qualidade em uma empresa do ramo automotivo que utilização o software vector VN1630A. Este, simula a utilização de comandos de central multimídia através do volante do veículo. Numa pré auditoria ISO fomos questionados sobre a validação deste software. Poderia dizer se nesse caso é necessário a validação?
Boa tarde, obrigada pelo contato. A validação de software é um controle que pode ser implementado em qualquer segmento. Porém, para alguns segmentos este processo é algo obrigatório para a obtenção do certificado de boas práticas, que é o caso da indústria farmacêutica por exemplo. Nestes casos, o processo de validação consiste em várias etapas (descritas nessa série de posts sobre validação). Quanto ao segmento automotivo, eu desconheço a obrigatoriedade de implementar validação de software nos mesmos moldes requeridos para a indústria farmacêutica, porém é algo que eu precisaria me aprofundar um pouco mais antes de lhe confirmar com mais precisão. Acredito que no seu caso, o auditor possa estar se referindo a testes para comprovar a correta performance do seu sistema, ou seja o que foi feito ou considerado que comprove que o sistema simula de forma consistente estes comandos multimídia. Não necessariamente estes testes precisam estar dispostos nos moldes que abordamos para as indústrias reguladas pela ANVISA. Obrigada